| Mọi thông tin dưới đây đã được Dược sĩ biên soạn lại. Tuy nhiên, nội dung hoàn toàn giữ nguyên dựa trên tờ Hướng dẫn sử dụng, chỉ thay đổi về mặt hình thức. |
1. Thành phần
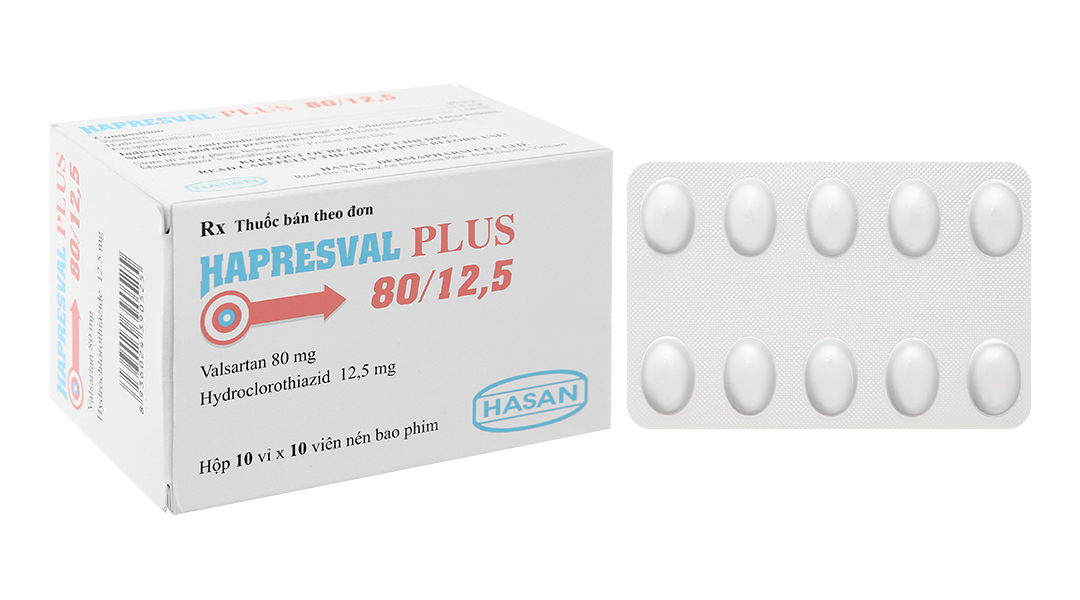
HAPRESVAL PLUS 80/12,5:
- Dược chất: Valsartan 80mg, Hydroclorothiazid 12,5mg.
- Tá dược: Lactose monohydrat, cellulose vi tinh thể 101, cellulose vi tinh thể 102, natri lauryl sulfat, crospovidon, silic dioxyd keo khan, magnesi stearat, HPMC 615, HPMC 606, PEG 6000, talc, titan dioxyd, oxyd sắt đỏ.
2. Công dụng (Chỉ định)
Hapresval Plus 80/12.5 điều trị tăng huyết áp vô căn ở người lớn. Chỉ định trong trường hợp bệnh nhân không đạt được huyết áp mục tiêu khi điều trị với valsartan hoặc hydroclorothiazid đơn độc.
3. Cách dùng - Liều dùng
Liều lượng:
Sử dụng viên có hàm lượng thích hợp.
- Liều dùng khuyến cáo là 1 viên/lần/ngày với HAPRESVAL PLUS 80/12,5. Khuyến cáo điều chỉnh liều đối với mỗi thành phần riêng rẽ. Ở mỗi trường hợp cụ thể, tăng liều từng thành phần để giảm thiểu nguy cơ hạ huyết áp và các tác dụng không mong muốn khác.
- Khi thích hợp về lâm sàng, thay đổi trực tiếp từ đơn trị liệu sang phối hợp cố định có thể được xem xét ở những bệnh nhân có huyết áp không được kiểm soát đầy đủ với đơn trị liệu valsartan hoặc hydroclorothiazid, thực hiện điều chỉnh liều được khuyến cáo với từng thành phần riêng lẽ.
- Nên đánh giá đáp ứng lâm sàng với thuốc sau khi khởi đầu điều trị. Nếu huyết áp vẫn không cải thiện, có thể điều chỉnh liều bằng cách tăng một trong hai thành phần của thuốc lên liều tối đa của valsartan/hydroclorothiazid là 320mg/25mg. Hiệu quả chống tăng huyết áp chỉ thể hiện rõ sau 2 tuần điều trị. Hiệu quả hạ huyết áp tối đa đạt được sau 4 tuần ở phần lớn bệnh nhân hoặc sau 4 - 8 tuần ở một vài bệnh nhân. Vì vậy nên cân nhắc trong quá trình điều chỉnh liều.
Liều lượng ở một số đối tượng lâm sàng đặc biệt:
- Bệnh nhân suy thận: Không cần điều chỉnh liều ở bệnh nhân suy thận nhẹ đến trung bình (GFR ≥ 30 ml/phút). Do có chứa thành phần hydroclorothiazid, không sử dụng HAPRESVAL PLUS ở bệnh nhân suy thận nặng (GFR < 30 ml/phút) và vô niệu. Chống chỉ định sử dụng đồng thời valsartan với aliskiren ở bệnh nhân suy thận (GFR < 60 ml/phút/ 1,73m2).
- Bệnh nhân đái tháo đường: Chống chỉ định sử dụng đồng thời valsartan với aliskiren ở bệnh nhân đái tháo đường.
- Bệnh nhân suy gan: Liều dùng của valsartan không được vượt quá 80mg ở bệnh nhân suy gan mức độ nhẹ đến trung bình và không kèm theo tắc mật. Không cần điều chỉnh liều hydroclorothiazid ở bệnh nhân suy gan nhẹ đến trung bình. Do có chứa thành phần valsartan, không sử dụng HAPRESVAL PLUS ở bệnh nhân suy gan nặng hoặc xơ gan mật, tắc mật.
- Người cao tuổi: Không cần điều chỉnh liều ở người cao tuổi.
- Trẻ em: Độ an toàn và hiệu quả của việc sử dụng chế phẩm phối hợp valsartan và hydroclorothiazid ở trẻ em < 18 tuổi chưa được chứng minh. Do đó không khuyến cáo sử dụng thuốc cho đối tượng này.
Cách dùng:
- Có thể sử dụng thuốc trước, trong hoặc sau bữa ăn.
- Thời gian dùng thuốc nên cố định mỗi ngày, thông thường vào buổi sáng. Không được tự ý thay đổi liều dùng hoặc ngưng sử dụng thuốc mà không được phép của bác sỹ. Bệnh tăng huyết áp thường không có triệu chứng vì vậy, cần tuân theo lịch thăm khám định kỳ ngay cả khi bệnh nhân vẫn cảm thấy khỏe mạnh.
- Nếu bệnh nhân quên dùng 1 liều thuốc, uống ngay sau khi nhớ ra. Nếu thời gian nhớ ra gần với thời điểm uống liều tiếp theo, hãy bỏ qua liều đã quên và tiếp tục uống liều tiếp theo như thường lệ. Không uống liều gấp đôi để bù cho liều đã quên.
- Không có yêu cầu đặc biệt về xử lý thuốc sau khi sử dụng.
- Không nên vứt bỏ thuốc vào nước thải hay rác sinh hoạt. Hỏi ý kiến dược sỹ cách bỏ thuốc không sử dụng nữa. Những biện pháp này sẽ giúp bảo vệ môi trường.
- Quá liều
Triệu chứng:
Quá liều với valsartan có thể gây hạ huyết áp triệu chứng, dẫn đến giảm mức độ nhận thức, ngất và/hoặc shock. Ngoài ra, những dấu hiệu và triệu chứng có thể xảy ra khi quá liều hydroclorothiazid gồm nôn mửa, buồn ngủ, giảm thể tích máu, rối loạn điện giải, loạn nhịp tim, co thắt cơ.
Cách xử trí:
Phương pháp điều trị phụ thuộc vào thời gian sử dụng quá liều thuốc, mức độ nghiêm trọng của các triệu chứng, sự ổn định của các bệnh tuần hoàn. Nếu hạ huyết áp, nên đặt bệnh nhân ở tư thế nằm và nhanh chóng bổ sung dịch và muối. Valsartan không được loại trừ bởi phương pháp thẩm tách vì gắn kết mạnh với protein huyết tương, trong khi đó, hydroclorothiazid có thể được đào thải bằng thẩm tách máu.
4. Chống chỉ định
- Quá mẫn với valsartan, hydroclorothiazid, các dẫn chất sulfonamid hay bất kỳ thành phần nào của thuốc.
- Phụ nữ mang thai 3 tháng giữa và cuối thai kỳ.
- Suy gan nặng, xơ gan tắc mật, ứ mật.
- Suy thận nặng (độ thanh thải creatinin < 30 ml/phút), vô niệu.
- Hạ kali huyết, hạ natri huyết, tăng calci huyết kháng trị và tăng acid uric huyết có triệu chứng.
- Phối hợp HAPRESVAL PLUS với chế phẩm chứa aliskiren ở bệnh nhân đái tháo đường hoặc suy thận (GFR < 60 ml/phút/1,73m2).
- Bệnh gout, bệnh Addison.
5. Tác dụng phụ
Các tác dụng không mong muốn được phân nhóm theo tần suất: rất thường gặp (ADR ≥ 1/10), thường gặp (1/100 ≤ ADR < 1/10), ít gặp (1/1000 ≤ ADR < 1/100), hiếm gặp (1/10000 ≤ ADR < 1/1000) và rất hiếm gặp (ADR < 1/10000).
Tác dụng không mong muốn của chế phẩm phối hợp valsartan và hydroclorothiazid:
- Chuyển hóa và dinh dưỡng: Mất nước (ít gặp).
- Thần kinh: Chóng mặt (rất hiếm gặp). Dị cảm (ít gặp). Ngất (không rõ tần suất).
- Mắt: Nhìn mờ (ít gặp).
- Tai và mê đạo: Ù tai (ít gặp).
- Mạch máu: Hạ huyết áp (ít gặp).
- Hô hấp, ngực, trung thất: Ho (ít gặp). Phù phổi không liên quan đến tim (không rõ tần suất).
- Tiêu hóa: Tiêu chảy (rất hiếm gặp).
- Cơ xương và mô liên kết: Đau cơ (ít gặp), đau khớp (rất hiếm gặp).
- Thận và tiết niệu: Suy thận (không rõ tần suất).
- Kết quả xét nghiệm: Tăng nồng độ acid uric, bilirubin, creatinin huyết thanh, hạ kali huyết, hạ natri huyết, tăng nồng độ BUN, giảm bạch cầu trung tính (không rõ tần suất).
- Các tác dụng không mong muốn khác: Mệt mỏi (không rõ tần suất).
Tác dụng không mong muốn của valsartan:
- Máu và hệ bạch huyết: Giảm hemoglobin, giảm hematocrit, giảm tiểu cầu (không rõ tần suất).
- Hệ thống miễn dịch: Các phản ứng quá mẫn, phản ứng dị ứng, bệnh huyết thanh (không rõ tần suất).
- Chuyển hóa và dinh dưỡng: Tăng nồng độ kali huyết, giảm natri huyết (không rõ tần suất).
- Tai và mê đạo: Chóng mặt (ít gặp).
- Mạch máu: Viêm mạch (không rõ tần suất).
- Tiêu hóa: Đau bụng (ít gặp).
- Gan mật: Tăng kết quả xét nghiệm chức năng gan (không rõ tần suất).
- Da và mô dưới da: Phù mạch, bỏng rộp da, phát ban, ngứa (không rõ tần suất).
- Thận và tiết niệu: Suy thận (không rõ tần suất).
Tác dụng không mong muốn của hydroclorothiazid:
- Khối u lành tính,ác tính và không xác định (bao gồm u nang và polyp): Ung thư da không phải là ung thư tế bào hắc tố (ung thư biểu mô tế bào đáy và ung thư biểu mô tế bào vảy) (không rõ tần suất). Dựa trên dữ liệu có sẵn từ các nghiên cứu dịch tễ học, mối liên quan phụ thuộc vào liều tích lũy của giữa hydroclorothiazid và MNSC đã được quan sát thấy.
- Máu và hệ bạch huyết: Giảm tiểu cầu, thỉnh thoảng ban xuất huyết (hiếm gặp). Bệnh giảm bạch cầu hạt, giảm bạch cầu, thiếu máu tán huyết, suy tủy xương (rất hiếm gặp). Thiếu máu không tái tạo (không rõ tần suất).
- Hệ thống miễn dịch: Phản ứng quá mẫn (rất hiếm gặp).
- Chuyển hóa và dinh dưỡng: Giảm kali huyết, tăng lipid huyết (chủ yếu ở liều cao) (rất thường gặp). Hạ natri huyết, hạ magnesi huyết, tăng acid uric huyết (thường gặp). Tăng calci huyết, tăng đường huyết, glucose niệu và làm trầm trọng tình trạng đái tháo đường (hiếm gặp). Nhiễm kiềm chuyển hóa (rất hiếm gặp).
- Tâm thần: Trầm cảm, rối loạn giấc ngủ (hiếm gặp).
- Thần kinh: Đau đầu, chóng mặt, dị cảm (hiếm gặp).
- Mắt: Giảm thị lực (hiếm gặp). Glaucom góc đóng cấp tính (không rõ tần suất).
- Tim: Loạn nhịp tim (hiếm gặp).
- Mạch: Hạ huyết áp thế đứng (thường gặp).
- Hô hấp, ngực, trung thất: Suy hô hấp, viêm phổi, phù phổi (rất hiếm gặp).
- Tiêu hóa: Mất vị giác, buồn nôn, nôn mửa (thường gặp). Táo bón, tiêu chảy, khó chịu ở đường tiêu hóa (hiếm gặp). Viêm tụy (rất hiếm gặp).
- Gan mật: Tắc mật hoặc vàng da (hiếm gặp).
- Thận và tiết niệu: Suy giảm chức năng thận, suy thận cấp (không rõ tần suất).
- Da và mô dưới da: Mày đay, các dạng phát ban (thường gặp). Nhạy cảm với ánh sáng (hiếm gặp). Viêm mạch hoại tử, hoại tử biểu bì nhiễm độc, phản ứng ban da giống lupus ban đỏ, lupus ban đỏ (rất hiếm gặp). Hồng ban đa dạng (không rõ tần suất).
- Cơ xương và mô liên kết: Co cơ (không rõ tần suất).
- Sinh sản: Liệt dương (thường gặp).
- Các phản ứng không mong muốn khác: sốt, suy nhược (không rõ tần suất).
Hướng dẫn xử trí tác dụng không mong muốn:
- Một số tác dụng không mong muốn có thể trở nên nghiêm trọng và cần chăm sóc y tế khẩn cấp bao gồm: Phù mạch (sưng mặt, lưỡi và họng, khó nuốt, nổi mày đay và khó thở) - cần đến gặp bác sĩ ngay lập tức; bệnh về da nghiêm trọng gây phát ban, đỏ da, phồng rộp môi, mắt hoặc miệng, bong tróc da, sốt (hoại tử thượng bì nhiễm độc); giảm thị lực hoặc đau mắt do tăng nhãn áp (có thể là dấu hiệu của bệnh glaucom góc đóng cấp tính); sốt, đau họng, nhiễm trùng thường xuyên hơn (mất bạch cầu hạt). Nếu gặp phải bất kì triệu chứng nào trong số các tác dụng không mong muốn này, cần ngừng thuốc và liên hệ với bác sĩ ngay lập tức.
6. Lưu ý
- Thận trọng khi sử dụng
- Nguy cơ tăng kali huyết khi sử dụng valsartan, đặc biệt trên các bệnh nhân suy tim hoặc có suy thận kèm theo. Điều trị với hydroclorothiazid có thể gây hạ kali huyết, nhiễm kiềm chuyển hóa giảm natri huyết và clo huyết, hạ magnesi huyết và tăng calci huyết. Cần theo dõi định kỳ nồng độ kali huyết, cân bằng nước và các chất điện giải khác khi sử dụng HAPRESVAL PLUS. Trong trường hợp bệnh nhân giảm thể tích nghiêm trọng do sử dụng thuốc lợi tiểu liều cao, chế độ ăn hạn chế muối, đang thẩm tách, tiêu chảy hoặc nôn, hạ huyết áp triệu chứng có thể xảy ra sau khi khởi đầu điều trị với HAPRESVAL PLUS. Nên điều trị giảm thể tích máu trước khi sử dụng thuốc.
- Bệnh nhân có chức năng thận phụ thuộc vào hệ renin-angiotensin-aldosteron (bệnh nhân suy tim sung huyết nặng), điều trị với thuốc ức chế enzym chuyển angiotensin có thể gây thiểu niệu và/hoặc tăng nitrogen urê huyết tiến triển và có thể dẫn đến suy thận cấp và/hoặc tử vong trong một số trường hợp. Độ an toàn và hiệu quả khi sử dụng HAPRESVAL PLUS ở bệnh nhân suy tim mạn tính nặng chưa được chứng minh.
- Thận trọng ở bệnh nhân còn một thận, hẹp động mạch thận hai bên hoặc hẹp động mạch thận một bên đơn độc do nguy cơ tăng nồng độ urê huyết hoặc creatinin huyết.
- Không khuyến cáo sử dụng HAPRESVAL PLUS ở bệnh nhân cường aldosteron tiên phát do hệ renin-angiotensin-aldosteron không được hoạt hóa ở những bệnh nhân này.
- Bệnh nhân hẹp động mạch chủ và van hai lá hoặc bệnh phì đại cơ tim tắc nghẽn.
- Không cần điều chỉnh liều ở bệnh nhân suy thận có độ thanh thải creatinin ≥ 30 ml/phút. Định kỳ theo dõi nồng độ kali huyết thanh, creatinin huyết và acid uric huyết ở bệnh nhân suy thận. Hiện nay, chưa có kinh nghiệm về tính an toàn khi sử dụng HAPRESVAL PLUS ở bệnh nhân vừa ghép thận.
- Thận trọng khi sử dụng HAPRESVAL PLUS ở bệnh nhân suy gan nhẹ đến trung bình và không kèm tắc mật. Hydroclorothiazid nên được sử dụng thận trọng ở bệnh nhân suy gan hoặc bệnh gan tiến triển do sự thay đổi nhỏ trong cân bằng nước và điện giải có thể thúc đẩy hôn mê gan.
- Cần ngừng sử dụng HAPRESVAL PLUS ngay lập tức khi có bất kỳ dấu hiệu phù mạch (phù thanh môn, thanh quản gây tắc nghẽn đường hô hấp và/hoặc phù mặt, môi, hầu họng) trong quá trình sử dụng thuốc.
- Hydroclorothiazid có thể khởi phát hoặc làm trầm trọng thêm lupus ban đỏ hệ thống.
- Hydroclorothiazid có thể thay đổi khả năng dung nạp glucose và làm tăng nồng độ cholesterol, triglycerid và acid uric trong huyết thanh, có thể cần điều chỉnh liều insulin và các thuốc điều trị đái tháo đường đường uống. Hydroclorothiazid có thể làm giảm bài tiết calci gây tăng nhẹ calci huyết. Tăng calci huyết có thể là dấu hiệu của bệnh cường tuyến cận giáp, vì vậy nên tạm thời ngừng sử dụng HAPRESVAL PLUS trước khi làm xét nghiệm chức năng tuyến cận giáp.
- Thận trọng khi sử dụng HAPRESVAL PLUS ở bệnh nhân có tiền sử quá mẫn với các thuốc đối kháng thụ thể angiotensin II. Phản ứng quá mẫn với hydroclorothiazid thường xảy ra hơn ở bệnh nhân dễ bị dị ứng hoặc hen suyễn.
- Hydroclorothiazid có thể gây ra phản ứng đặc ứng dẫn đến cận thị thoáng qua và glaucom góc đóng cấp tính. Các triệu chứng bao gồm giảm thị lực khởi phát cấp tính hoặc đau mắt, thường xảy ra trong vòng vài giờ đến vài tuần khi bắt đầu sử dụng thuốc. Không điều trị glaucom góc đóng cấp tính có thể dẫn đên mất thị lực vĩnh viễn. Bệnh nhân có tiền sử dị ứng với sulfonamid hoặc penicillin tăng nguy cơ gặp phải glaucom góc đóng cấp tính khi sử dụng thuốc.
- Phong bế kép hệ renin-angiotensin-aldosteron bằng việc sử dụng đồng thời các thuốc ức chế enzym chuyển angiotensin, thuốc đối kháng thụ thể angiotensin hoặc aliskiren làm tăng nguy cơ hạ huyết áp, tăng kali huyết và suy giảm chức năng thận (bao gồm suy thận cấp). Vì vậy không khuyến cáo phối hợp các thuốc trên.
- Ung thư da không phải là ung thư tế bào hắc tố (NMSC): Tăng nguy cơ NMSC (ung thư biểu mô tế bào đáy - BCC và ung thư biểu mô tế bào vảy - SCC) cùng với tăng liều tích lũy hydroclorothiazid đã được quan sát thấy trong hai nghiên cứu dịch tễ học dựa trên Cơ quanđăng ký ung thư quốc gia Đan Mạch (Danich National Cancer Registry). Hydroclorothiazid nhạy cảm với ánh sáng có thể liên quan đến cơ chế của NMSC. Bệnh nhân dùng hydroclorothiazid nên được thông báo về nguy cơ NMSC và thường xuyên kiểm tra da xem có bất kỳ tổn thương mới nào không và báo cáo kịp thời mọi tổn thương da đáng ngờ (có thể bao gồm kiểm tra mô học của sinh thiết). Các biện pháp phòng ngừa có thể bao gồm hạn chế tiếp xúc với ánh sáng mặt trời và tia UV, trường hợp phơi nhiễm, cần bảo vệ đầy đủ cho bệnh nhân để giảm thiểu nguy cơ ung thư da. Sử dụng hydroclorothiazid có thể cần được xem xét lại ở bệnh nhân đã bị NMSC trước đó.
- Chế phẩm HAPRESVAL PLUS chứa lactose, không sử dụng ở bệnh nhân mắc rối loạn di truyền hiếm gặp về không dung nạp galactose, thiếu hụt Lapp lactase hoặc rối loạn dung nạp glucose - galactose không nên dùng thuốc này.
- Thai kỳ và cho con bú
Phụ nữ mang thai:
- Không khuyến cáo sử dụng HAPRESVAL PLUS trong ba tháng đầu thai kỳ, chống chỉ định sử dụng trong ba tháng giữa và cuối thai kỳ.
- Sử dụng valsartan ở phụ nữ có thai trong ba tháng giữa và ba tháng cuối thai kỳ có thể gây tổn hại cho thai nhi (suy giảm chức năng thận, ít nước ối, chậm cốt hóa xương sọ) và trẻ sơ sinh (suy thận, hạ huyết áp, tăng kali huyết), thậm chí có thể gây chết thai. Mặc dù các nghiên cứu dịch tễ học hiện chưa chứng minh được nguy cơ gây quái thai khi sử dụng thuốc trong ba tháng đầu của thai kỳ nhưng không thể loại trừ được hoàn toàn nguy cơ này. Khi phát hiện có thai, bệnh nhân đang điều trị bằng valsartan cần ngừng ngay thuốc và điều trị thay thế bằng thuốc khác. Nếu đã sử dụng valsartan trong một thời gian dài từ ba tháng giữa thai kỳ, cần siêu âm kiểm tra chức năng thận và chụp sọ của thai nhi. Trẻ sơ sinh có mẹ sử dụng valsartan trong thời kỳ mang thai cần được theo dõi chặt chẽ nguy cơ hạ huyết áp.
- Kinh nghiệm sử dụng hydroclorothiazid trên phụ nữ mang thai còn hạn chế, đặc biệt là ba tháng đầu thai kỳ. Nghiên cứu trên động vật vẫn chưa đầy đủ. Hydroclorothiazid qua được nhau thai. Dựa trên cơ chế dược lý học, sử dụng hydroclorothiazid 3 tháng giữa và cuối thai kỳ có thể giảm tưới máu nhau thai - bào thai, gây rối loạn điện giải, vàng da, giảm tiểu cầu ở trẻ sơ sinh.
Phụ nữ cho con bú:
- Không có thông tin về việc sử dụng valsartan ở phụ nữ cho con bú. Hydroclorothiazid được tiết vào sữa mẹ. Vì vậy, không khuyến cáo sử dụng HAPRESVAL PLUS ở phụ nữ cho con bú. Nên lựa chọn các phương pháp điều trị thay thế đã được chứng minh an toàn hơn đối với thời kỳ cho con bú, đặc biệt trong trường hợp trẻ mới sinh hoặc trẻ sinh non.
- Khả năng lái xe và vận hành máy móc
Không có nghiên cứu về ảnh hưởng của thuốc trên công việc. Tuy nhiên, HAPRESVAL PLUS có thể gây chóng mặt, mệt mỏi, nên thận trọng khi vận hành tàu xe, máy móc, làm việc trên cao hoặc các trường hợp khác.
- Tương tác thuốc
Tương tác của thuốc
Tương tác của valsartan và hydroclorothiazid:
Không sử dụng đồng thời HAPRESVAL PLUS với các thuốc sau:
- Lithi: Nguy cơ ngộ độc lithi có thể xảy ra với HAPRESVAL PLUS. Nếu bắt buộc phải sử dụng đồng thời, cần theo dõi chặt chẽ nồng độ lithi huyết thanh.
Thận trọng khi sử dụng đồng thời Hapresval plus với các thuốc sau:
- Thuốc điều trị tăng huyết áp khác: Làm tăng tác dụng hạ huyết áp.
- Các amin giao cảm (noradrenalin, adrenalin): HAPRESVAL PLUS làm giảm phản ứng với các amin giao cảm. Ý nghĩa lâm sàng của tương tác này chưa được xác định.
- Thuốc kháng viêm không steroid (NSAID), aspirin (> 3 g/ngày): NSAID có thể làm giảm tác đồng hạ huyết áp của valsartan và hydroclorothiazid, gây giảm chức năng thận và tăng nồng độ kali huyết thanh.
Tương tác của valsartan:
- Phong bể kép hệ renin-angiotensin-aldosteron bằng thuốc đối kháng thụ thể angiotensin II, thuốc ức chế enzym chuyển angiotensin, aliskiren: Làm tăng tần suất các tác dụng không mong muốn (hạ huyết áp, tăng kali huyết, suy giảm chức năng thận).
- Thuốc lợi tiểu giữ kali, viên bổ sung kali hoặc các thuốc khác có thể gây tăng nồng độ kali huyết: Không sử dụng đồng thời valsartan với các thuốc trên.
- Nghiên cứu in vitro cho thấy valsartan là cơ chất của protein vận chuyển anion hữu cơ (OATP) 1B1/1B3 và protein đề kháng đa thuốc MRP 2. Những chất ức chế OATP 1B1 (rifampin, ciclosporin) và MRP 2 (ritonavir) có thể làm tăng sự tiếp xúc toàn thân của valsartan. Thận trọng khi phối hợp các thuốc này trong giai đoạn khởi đầu hoặc kết thúc điều trị.
- Trong các nghiên cứu, không thấy tương tác có ý nghĩa của valsartan với các thuốc như cimetidin, warfarin, furosemid, digoxin, atenolol, indomethacin, hydroclorothiazid, amlodipin, glibenclamid. Tuy nhiên, có tương tác giữa digoxin và indomethacin với hydroclorothiazid.
Tương tác của hydroclorothiazid:
Thận trọng khi phối hợp hvdroclorothiazid với các thuốc sau:
- Thuốc ảnh hưởng đến nồng độ kali huyết thanh (thuốc lợi tiểu thải kali, corticosteroid, thuốc nhuận tràng, ACTH, amphotericin, carbenoxolon, aspirin và dẫn chất): Tăng nguy cơ hạ kali huyết khi phối hợp với hydroclorothiazid.
- Thuốc gây xoắn đỉnh: Nguy cơ gây hạ kali huyết.
- Thuốc ảnh hưởng đến nồng độ natri huyết thanh (thuốc điều trị trầm cảm, thuốc an thần, thuốc chống động kinh): Làm tăng tác động hạ natri huyết.
- Glycosid tim: Tác động hạ kali huyết và hạ magnesi huyết gây ra bởi thiazid có thể thúc đẩy tác động gây loạn nhịp bởi glycosid tim.
- Muối calci và vitamin D: Tăng nồng độ calci trong huyết thanh. Sử dụng chung với muối calci có thể gây tăng calci ở bệnh nhân cường tuyến cận giáp, u ác tính.
- Thuốc điều trị đái tháo đường: Hydroclorothiazid làm thay đổi dung nạp glucose, có thể cần điều chỉnh liều của các thuốc điều trị đái tháo đường. Nên sử dụng metformin thận trọng do nguy cơ nhiễm acid lactic do suy thận liên quan đến hydroclorothiazid.
- Thuốc chẹn beta và diazoxid: Nguy cơ tăng đường huyết.
- Thuốc điều trị gout (probenecid, sulfinpyrazon, allopurinol): Cần tăng liều probenecid hoặc sulfinpyrazon do hydroclorothiazid có thể gây tăng nồng độ acid uric trong huyết thanh. Phối hợp hydroclorothiazid với allopurinol có thể gây tăng phản ứng quá mẫn do allopurinol.
- Thuốc kháng cholinergic và các thuốc ảnh hưởng tới nhu động ruột: Các thuốc kháng cholinergic (atropin, biperiden) có thể làm tăng sinh khả dụng của thuốc lợi tiểu thiazid. Ngược lại, cisaprid có thể làm giảm sinh khả dụng của thiazid.
- Amantadin: Gia tăng tác dụng không mong muốn của hydroclorothiazid.
- Nhựa trao đổi ion: Cholestyramin và colestipol làm giảm hấp thu và có thể gây giảm hiệu quả điều trị của hydroclorothiazid. Nên uống hydroclorothiazid trước ít nhất 4 giờ và sau 4 - 6 giờ khi sử dụng các thuốc trên.
- Tác nhân gây độc tế bào: Hydroclorothiazid có thể làm giảm bài tiết qua thận của các tác nhân gây độc tế bào như (cyclophosamid, methotrexat) và tăng cường tác dụng ức chế tủy xương.
- Thuốc giãn cơ không khử cực (tubocurarin): Hydroclorothiazid có thể làm tăng đáp ứng với thuốc giãn cỡ.
- Ciclosporin: Điều trị đồng thời với ciclosporin có thể gây tăng nguy cơ tăng acid uric huyết và các biến chứng gout.
- Rượu, barbiturat hoặc thuốc gây ngủ: Tăng nguy cơ hạ huyết áp thế đứng.
- Methyldopa: Đã có báo cáo riêng biệt về thiếu máu tán huyết ở bệnh nhân sử dụng đồng thời methyldopa và hydroclorothiazid.
- Thuốc cản quang chứa iod: Tăng nguy cơ suy thận cấp khi sử dụng liều cao iod. Bệnh nhân cần được bổ sung đủ dịch trước khi sử dụng thuốc.
Tương kỵ của thuốc
Không áp dụng.
7. Dược lý
- Dược động học (Tác động của cơ thể với thuốc)
Chế phẩm phối hợp valsartan và hydroclorothiazid:
Sinh khả dụng của hydroclorothiazid giảm khoảng 30% khi phối hợp đồng thời với valsartan, dược động học của valsartan không bị ảnh hưởng rõ rệt. Tương tác này không ảnh hưởng đến hiệu quả của chế phẩm phối hợp valsartan và hydroclorothiazid vì các thử nghiệm lâm sàng chứng minh được hiệu quả của chế phẩm phối hợp so với từng dược chất riêng rẽ hoặc placebo.
Valsartan:
- Hấp thu: Valsartan hấp thu nhanh, nồng độ đỉnh trong huyết tương đạt khoảng 2 - 4 giờ sau khi uống. Sinh khả dụng đường uống khoảng 25%. Thức ăn làm giảm khoảng 40% AUC và khoảng 50% Cmax, nhưng nồng độ huyết tương sau khi uống 8 giờ tương tự nhau dù bệnh nhân đói hay no. Tuy vậy, AUC giảm không kèm theo giảm tác dụng lâm sàng có ý nghĩa. AUC và Cmax của valsartan tăng tỉ lệ tuyến tính với liều dùng trong khoảng liều được khuyến cáo trên lâm sàng.
- Phân bố: Valsartan liên kết khoảng 94 - 97% với protein huyết tương, chủ yếu là albumin.
- Chuyển hóa: Valsartan không được chuyển hóa đáng kể, chỉ 20% liều tìm thấy dưới dạng chất chuyển hóa. Chất chuyển hóa valeryl-4-hydroxy valsartan không có hoạt tính được tìm thấy trong nước tiểu và phân. Chưa xác định được chính xác các enzym tham gia chuyển hóa valsartan nhưng có thể không thông qua hệ enzym cytocrom P450.
- Thải trừ: Valsartan được thải trừ theo nhiều pha (T1/2 alpha < 1 giờ, T1/2 beta khoảng 9 giờ), chủ yếu qua đường mật vào phân (khoảng 83%) nhưng cũng qua thận vào nước tiểu (khoảng 13% liều), phần lớn dưới dạng không đổi. Thời gian bán thải của valsartan khoảng 6 giờ.
Hydroclorothiazid:
- Hấp thu: Sau khi uống, hydroclorothiazid hấp thu tương đối nhanh, khoảng 65 - 75% liều, tỉ lệ này có thể giảm ở người suy tim. Thức ăn có thể giảm hấp thu thuốc.
- Phân bố: Hydroclorothiazid liên kết 40 - 68% với protein huyết tương; tích lũy trong hồng cầu; qua hàng rào nhau thai, phân bố và đạt nồng độ cao trong thai nhi.
- Chuyển hóa: Hydroclorothiazid không bị chuyển hóa.
- Thải trừ: Hydroclorothiazid đào thải chủ yếu qua thận dưới dạng không chuyển hóa. Thời gian bán thải trong huyết tương từ 9,5 - 13 giờ nhưng có thể kéo dài trong trường hợp suy thận.
Dược động học trong một số trường hợp lâm sàng đặc biệt:
- Người cao tuổi: Giá trị AUC của valsartan tăng nhẹ ở người cao tuổi, tuy nhiên không có tác động ý nghĩa trên lâm sàng. Một số tài liệu cho rằng độ thanh thải của hydroclorothiazid giảm ở cả người cao tuổi khỏe mạnh và người cao tuổi tăng huyết áp khi so sánh với người trẻ.
- Bệnh nhân suy thận:
+ Với mức liều khuyến cáo, không cần điều chỉnh liều ở bệnh nhân có tốc độ lọc cầu thận (GFR) 30 - 70 ml/phút. Không có dữ liệu sử dụng chế phẩm phối hợp valsartan và hydroclorothiazid ở bệnh nhân suy thận nặng (GFR < 30 ml/phút) và bệnh nhân đang thẩm tách máu. Valsartan không được đào thải bằng thẩm tách, ngược lại với hydroclorothiazid.
+ Ở bệnh nhân suy thận, nồng độ đỉnh trong huyết tương và giá trị AUC của hydroclorothiazid tăng đồng thời tốc độ đào thải qua thận giảm. Giá trị AUC tăng gấp 3 lần ở bệnh nhân suy thận mức độ nhẹ đến trung bình và tăng gấp 8 lần ở bệnh nhân suy thận nặng. Chống chỉ định sử dụng hydroclorothiazid ở bệnh nhân suy thận nặng.
- Bệnh nhân suy gan: Thử nghiệm dược động học ở bệnh nhân suy gan mức độ nhẹ đến trung bình, giá trị AUC của valsartan tăng khoảng 2 lần, không có dữ liệu nghiên cứu trên bệnh nhân suy gan nặng. Bệnh gan không ảnh hưởng đến dược động học của hydroclorothiazid.
- Dược lực học (Tác động của thuốc lên cơ thể)
Phân loại dược lý:
Thuốc điều trị tăng huyết áp, nhóm thuốc đối kháng thụ thể angiotensin II và thuốc lợi tiểu.
Mã ATC: C09DA03.
Cơ chế tác dụng:
Valsartan:
- Valsartan là thuốc đối kháng thụ thể type 1 của angiotensin II (AT1), không phải là tiền chất nên tác dụng dược lý của thuốc không phụ thuộc vào phản ứng thủy phân ở gan. Ái lực của angiotensin II trên thụ thể AT1 và AT2 tương tự nhau, trong khi đó, ái lực của valsartan đối với thụ thể AT1 mạnh gấp khoảng 20000 lần so với ái lực với thụ thể AT2. Thụ thể AT1 tham gia vào hầu hết hoặc tất cả các hoạt động trên tim mạch, thận và thần kinh trung ương. Valsartan ức chế chọn lọc angiotensin II gắn vào thụ thể AT1 ở nhiều mô khác nhau, trong đó có cơ trơn mạch máu và tuyến thượng thận, làm hạ huyết áp bằng cách đối kháng các tác dụng gây ra bởi angiotensin II (co mạch, tăng bài tiết aldosteron, tăng bài tiết catecholamin ở tuyến thượng thận và trước synap, giải phóng arginin vasopressin, tái hấp thu nước và gây phì đại cơ tim). Valsartan không ức chế giáng hóa bradykinin, do đó không gây ra các phản ứng bất lợi như ho khan dai dẳng, thường xảy ra với các thuốc ức chế enzym chuyển angiotensin.
- Tác dụng hạ huyết áp xuất hiện khoảng 2 giờ sau khi uống, đạt cực đại sau 4 - 6 giờ và duy trì tác dụng trong 24 giờ. Khi dùng liều lặp lại, tác dụng chống tăng huyết áp thể hiện rõ rệt sau 2 tuần, đạt tối đa sau 4 tuần và được duy trì khi điều trị dài ngày. Tỉ lệ đáy/đỉnh của hiệu quả giảm huyết áp tâm thu và huyết áp tâm trương tương ứng là 78% và 74% cho thấy thuốc có thể sử dụng 1 lần/ngày trong kiểm soát huyết áp.
Hydroclorothiazid:
- Hydroclorothiazid làm tăng bài tiết natri clorid và nước do cơ chế ức chế tái hấp thu các ion natri và clorid ở ống lượn xa; tăng bài tiết các ion kali, magnesi, bicarbonat và có thể cũng làm giảm tốc độ lọc cầu thận. Tác dụng lợi tiểu ở mức độ vừa phải.
- Hydroclorothiazid có tác dụng hạ huyết áp, đầu tiên là do giảm thể tích huyết tương và dịch ngoại bào liên quan đến sự bài niệu natri, sau đó trong quá trình dùng thuốc, tác dụng hạ huyết áp tùy thuộc vào sự giảm sức cản ngoại vi, thông qua sự thích nghi dần của các mạch máu trước tình trạng giảm nồng độ ion natri. Tác dụng lợi tiểu có thể thấy sau vài giờ, còn tác dụng hạ huyết áp xảy ra chậm sau 1 - 2 tuần. Tác dụng chống tăng huyết áp thường đạt được tối ưu ở liều 12,5mg và chỉ có thể đạt được tác dụng đầy đủ sau 2 tuần.
- Trong các thử nghiệm lâm sàng, tác động gây giảm kali huyết được hạn chế bởi tác động giữ kali của valsartan.
8. Thông tin thêm
- Đặc điểm
- HAPRESVAL PLUS 80/12,5: Viên nén hình oval, bao phim màu hồng, hai mặt lồi, một mặt có khắc chữ “HS”, cạnh và thành viên lành lặn.
- Bảo quản
Nơi khô, dưới 30°C. Tránh ánh sáng.
- Hạn dùng
36 tháng kể từ ngày sản xuất.
- Nhà sản xuất
Hasan - Dermapharm Co., Ltd.








.jpg)
.jpg)


